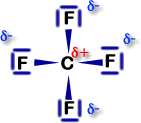
Polare Atombindung,
ΔEN = 4,1 - 2,5 = 1,6
tetraedrisch
Bei den folgenden Aufgaben musst du darauf achten, dass
jedes Element die richtige Anzahl der Außenelektronen
(Valenzelektronen) hat (nutzte dein PSE) und dass alle Atome
die Edelgasregel erfüllen. Achte auch auf den räumlichen Bau!
1. Zeichne die unten genannten Moleküle in Lewis-Formeln, achte dabei...
2. ob du die bindenden Elektronenpaare als Striche oder Keile schreiben musst.
3. Liegt eine unpolare Atombindung oder polare Atombindung vor. Begründe!
4. Zeichne annähernd räumlich richtig. Denkt dabei an das Kugelwolkenmodell und welche einfach
besetzten Orbitale sich überlappen.
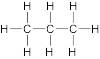
ΔEN (C-C) = 2,5 - 2,5 = 0
= unpolar;
ΔEN (C-H) = 2,5 - 2,2 = 0,3
=unpolar
Unpolare Atombindung,
ΔEN = 2,2 - 2,2 = 0