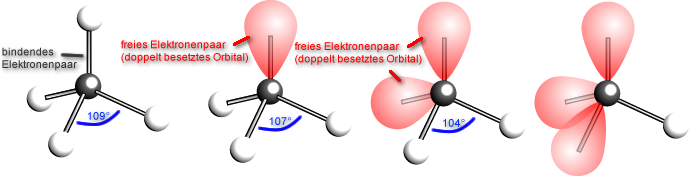
Merke: Nichtbindende Elektronenpaare nehmen einen größeren
Raum als bindende!
Zur Erklärung der einzelnen unterschiedlichen Bindungswinkel,
fahre mit der Maus über die einzelnen Moleküle.
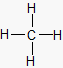
Methan: Bindungswinkel
109,5 °
Die 4 Wasserstoff-Atome
sind tetraedrisch um das
Kohlenstoff-Atom
angeordnet. Die bindenden
Elektronenpaare haben
somit den größtmöglichen
Abstand voneinander.
Ammoniak:
Bindungswinkel 107 °
Hier stoßen sich die drei
bindenden und das eine freie
Elektronenpaar gegenseitig
ab. Die Winkel zwischen den
bindenden Elektronenpaaren
sind jedoch nur 107°.
Freies Elektronenpaar braucht
mehr Platz (stärker
Abstoßung, da nur zweifach
negativ geladen (2 e- und
keine Protonen)
Wasser: Bindungswinkel
104 °
Da es zwei doppelt
besetzte Orbitale (zwei
freie Elektronenpaare) gibt,
die mehr Platz brauchen,
drücken diese noch stärker
die bindenden
Elektronenpaare zu den H-Atomen zusammen. Der
Winkel ist noch kleiner.
Fluorwasserstoff:
Da es nur eine
Bindung gibt, spricht
man hier von einem
"linearen Molekül".