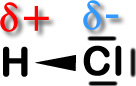Welche Auswirkung hat nun die Elektronegativität auf eine Atombindung. Hierzu zunächst einige Beispiele. Später
dann dazu einige Übungen.
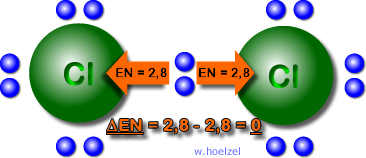
Bei der unpolaren Atombindung werden die
Bindungselektronen von beiden Atomen gleich oder
nahezu gleich angezogen. Bsp.: O2, Cl2, etc.
Die Differenz der Elektronegativität der beiden
Elementen: grober Richtwert: ΔEN = 0 bis 0,4
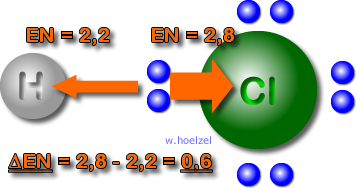
Bei der polaren Atombindung werden die
Bindungselektronen von dem Atomen mit der
größeren EN angezogen. Bsp.: HCl, H2O, etc.
Die Differenz der Elektronegativität der beiden
Elementen: grober Richtwert: ΔEN = ca. 0,5 bis 1,8
Um die polaren Bindungen auch bei Strukturformeln anzuzeigen gibt es
zwei Möglichkeiten.
1. Keile, die anzeigen, welches Elemente "mehr" Elektronen hat!
2. Angabe von Teilladungen: δ + und δ -. Dabei handelt es sich nicht um
ganze Ladungen (wie z.B. 1+, sondern um einen Teilbetrag. Hier
könnte z.B. der Wasserstoff die Ladung 0,23 + und das Chlor die
Teilladung - 0,23 besitzen.
Positive Teilladung:
Der Wasserstoff ist etwas
positiver geladen.
Allerdings ist die Ladung
kleiner als 1+.
Negative Teilladung:
Der Wasserstoff ist etwas
negativ geladen.
Allerdings ist die Ladung
kleiner als 1-.
Dieser Keil soll
verdeutlichen, dass Chlor
die Elektronen an sich
gezogen hat.