So einfach, wie Niels Bohr sich das vorstellt, war es allerdings nicht mit der Verteilung der Elektronen innerhalb
einer Schale.
Es gibt bestimmt Bereiche, in denen sich die Elektronen mit größerer Wahrscheinlichkeit aufhalten, sogenannte
Orbitale. In den folgenden Seiten wird ein sehr stark vereinfachtes Orbitalmodell besprochen, das
Kugelwolkenmodell.
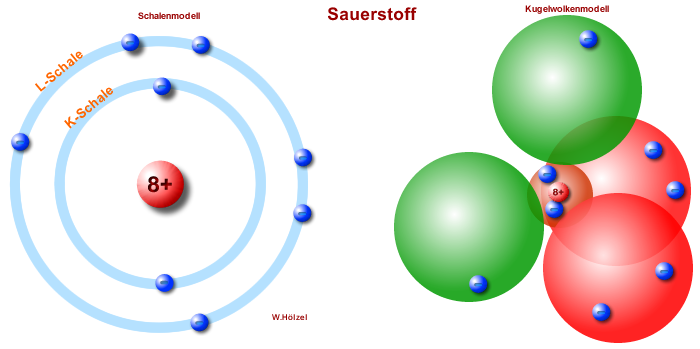
Hier ist ein Vergleich, zwischen dem Schalenmodell und dem
Kugelwolkenmodell. Fahrt über die jeweiligen Bereich, um Erläuterungen
gezeigt zu bekommen.
Atomkern mit 8 Protonen;
Anzahl der Neutronen ist nicht
angegeben.
Orbitale der K-Schale = Kugelwolke
= Bereich, in dem sich die Elektronen mit
einer Wahrscheinlichkeit von ca. 90% aufhält.
Elektronen:
Bohr = auf Kreisbahnen;
Kugelwolkenmodell = in
besonderen Bereichen = Orbitale
Orbitale der L-Schale = Kugelwolke
= Bereich, in dem sich die Elektronen mit
einer Wahrscheinlichkeit von ca. 90% aufhält.
Vorsicht: Orbitale sind keine Körper sondern
nur Bereiche.
Grün = in diesem Bereich ist nur 1 Elektron;
Rot = in diesem Bereich sind 2 Elektronen.
Auch die Orbitale sind in Energiestufen
angeordnet. Das kleine Orbital um den Kern
entspricht der K-Schale.