Um herauszufinden, ob eine Dipol-Dipol-Wechselwirkung vorliegt, muss man als erstes überprüfen, ob das
Moleküle einen permanenten Dipol besitzt; hier am nächsten Beispiel durchexerziert.
Überprüfung: Liegt ein permanenter Dipol vor?
1. Schritt: Besitzt das Molekül eine polare Bindung?
- Dafür müssen wir die Elektronegativitätsdifferenz bestimmen:
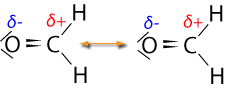
- Bindung O=C ΔEN = EN(O) - EN(C)
= 3,5 - 2,5 = 1 (polare Bindung liegt vor da zwischen 0,4 und 1,7)
- Bindung H-C ΔEN = EN(C) -
EN(H) = 2,5 - 2,2 = 0,3 (fast unpolare Bindung, wird nicht berücksichtigt)
2. Schritt: Fallen die Ladungsschwerpunkte in einem Punkt zusammen (Elektronen sind symmetrisch verteilt)?
- Falls ja: kein Dipol;
- Falls nein: Dipol.
Bei Methanal fallen die Ladungsschwerpunkte nicht in einem Punkt zusammen, folglich ist es nicht
"symmetrisch"und ein Dipol liegt vor.
Ergebnis: Es liegt ein permanenter Dipol bei Methanal vor, folglich wirken bei Methanal-Moleküle Dipol-Dipol-Wechselwirkungen.
Dipol-Dipol-Wechselwirkungen