Teilchen, in denen die Schwerpunkte der positiven und negativen Ladungen nicht zusammenfallen (asymmetrisch
verteilt sind), sind elektrische Dipole.
Wie schon im Kapitel Atombindung gesehen, kann treten bei
polaren Atombindungen Teilladungen auf.
Dipol-Dipol-Wechselwirkungen:
In der Chemie haben wir es einfach: Wir können,
dass sich immer "Plus" und "Minus" anziehen.
Kommt es also zur Ausbildung von
Anziehungskräften, muss eine "positive"
(Teil)Ladung und eine "negative" (Teil)Ladung
vorliegen.
Oder andersherum gesagt: Liegen "positive" und
"negative" Teilladungen vor, ziehen die sich an.
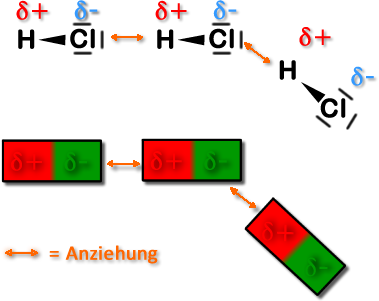
An dem nebenstehenden Beispiel kann man
erkennen, dass sich das "positivierte"
Wasserstoffatom und das "negativierte" Chloratom
im Chlorwasserstoffmolekül anziehen.
Dadurch kann man Chlorwasserstoff überhaupt
verflüssigen ( bei -85,03 °C)