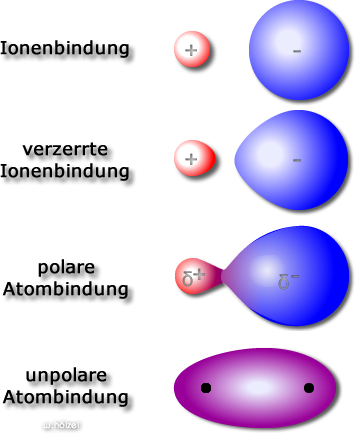
Ganz so eindeutig, wie bisher behauptet ist das mit den Bindungen allerdings nicht. Je nach Bindungspartner
kommen Übergangzustände zwischen den einzelnen Bindungen vor. Fahre mit der Maus über die Abbildung für
weitere Informationen.
Große EN-Differenz; Bsp.: CsF
Häufiger, als die reine Ionenbindung. Das
positive Kationen zieht die negative
Ladungswolke des Anions an und doformiert
(= polarisiert) sie.
Ionen, die leicht deformiert werden: große
Ionen (Valenzelektronen sind weit vom Kern
weg) oder die mehrfache Ladungen haben.
Bei zwei unterschiedlichen Atomen sind die
Ladungen nicht symmetrisch verteilt,
sondern ein Atom zieht immer etwas stärker
die Elektronen an, als das andere. Wir
sprechen vereinfacht aber erst dann von
einer polaren Atombindung, wenn ein ΔEN
Wert von 0,4 überschritten wird.
nur zwischen gleichen Atomen; Bsp: F2, O2,
N2, H2, etw.