Die Atombindung hat noch einige andere Bezeichnungen: Elektronenpaarbindung, kovalente Bindung oder
Molekülbindung.
Atome erreichen die Edelgaskonfiguration (und erfüllen damit die
Edelgasregel), indem sie chemische Reaktionen eingehen und dadurch
Elektronen mit anderen Atomen gemeinsam teilen (Atombindung).
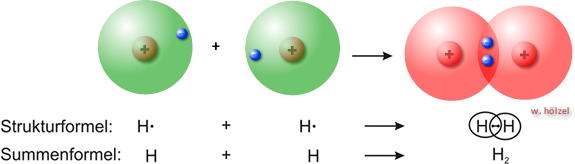
Nähern sich zwei Wasserstoffatome (H•), so können sich die beiden „Kugelwolken“
(Orbitale) in
einem gewissen Ausmaß durchdringen („überlappen“). Es bildet sich eine neue Molekülorbital, die
beide Atomkerne umschließt.
Zwischen den beiden Kernen kommt es zu einer Verdichtung der negativen Ladung, zu
der beide
Elektronen gleichviel beitragen und die zur Anziehung zwischen den beiden positiv geladenen
Kernen führt. Die beiden Elektronen bezeichnet man als bindendes Elektronenpaar. Beide Atome
nutzen das Elektronenpaar gemeinsam. Damit ist erfüllen beide Wasserstoffatome die Edelgasregel.
Unwissenschaftlich (da Atome keine Gefühle besitzen) könnte man sagen, dass Atome mit
unbesetzten Orbitalen (= grüne Orbitale) "unglücklich" sind. Sind alle 4 Orbitale voll besetzt, sind
sie "glücklich". Unglücklich bedeutet hier: energetisch ungünstig, glücklich = energetisch günstig.